新东方网>长春新东方学校>优能中学>优能初中>中考资讯>正文
中考化学复习基本概念和基本理论
2016-06-16 09:26
来源:新东方
作者:新东方
中考化学复习基本概念和基本理论由长春新东方同步新东方整理发布,更多精彩内容,请持续关注长春新东方官方网站及长春新东方学校公众号【ccxdfcn】。
一、基本概念和基本理论
(一)物质的变化和性质
1.物质的变化:物理变化:没有生成其他物质的变化。化学变化:生成了其他物质的变化。
化学变化和物理变化常常同时发生。物质发生化学变化时一定伴随物理变化;而发生物理变化
不一定同时发生化学变化。物质的三态变化(固、液、气)是物理变化。物质发生物理变化时
只是分子间的间隔发生变化,而分子本身没有发生变化;发生化学变化时,分子被破坏,分子
本身发生变化。化学变化的特征:生成了其他物质的变化。
2.物质的性质 (描述性质的语句中常有“能……”“可以……”等字)
物理性质:颜色、状态、气味、熔点、沸点、硬度、密度、溶解性。
化学性质:通过化学变化表现出的性质。如还原性、氧化性、酸性、碱性、可燃性、热稳定性。
元素的化学性质跟原子的最外层电子数关系最密切。原子的最外层电子数决定元素的化学性质。
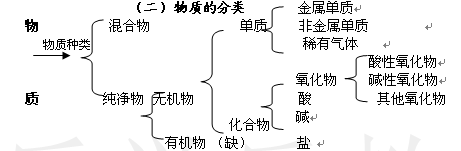
3.混合物:是由两种或两种以上的物质混合而成(或由不同种物质组成) 例如,空气,溶液(盐酸、
澄清的石灰水、碘酒、矿泉水)矿物(煤、石 油、天然气、铁矿石、石灰石),合金(生铁、钢)
注意:氧气和臭氧混合而成的物质是混合物,红磷和白磷混合也是混合物。
纯净物、混合物与组成元素的种类无关。即一种元素组成的物质可能是纯净物也可能是混合物,
多种元素组成的物质可能是纯净或混合物。
4.纯净物:由一种物质组成的。 例如:水、 水银、 蓝矾(CuSO4 ·5H2 O)都是纯净物
冰与水混合是纯净物。 名称中有“某化某”“某酸某”的都是纯净物,是化合物。
5.单质:由同种(或一种)元素组成的纯净物。例如:铁 氧气(液氧)、氢气、水银。
6.化合物:由不同种(两种或两种以上)元素组成的纯净物。名称中有“某化某”“某酸某”的是化合物。
7.有机物(有机化合物):含碳元素外的化合物(除CO、CO2 和含碳酸根化合物外)
无机物:不含碳元素的化合物以及CO、CO2 和含碳酸根的化合物
8. 氧化物:由两种元素组成,其中一种是氧元素的化合物。
a. 酸性氧化物:跟碱反应生成盐和水的氧化物CO2 ,SO2 ,SO3
b. 大部分非金属氧化物都是酸性氧化物,跟水反应生成同价的含氧酸。
CO2 + H2O= H2CO3 SO2 + H2O= H2SO3 SO3 + H2O= H2SO4
b.碱性氧化物:跟酸反应生成盐和水的氧化物。CaO Na2 O MgO Fe2 O3 CuO
大部分金属氧化物都是碱性氧化物, BaO K2 O CaO Na2 O溶于水立即跟水反应
生成相应的碱,其他碱性氧化物不溶于水,跟水不反应。
CaO+H2O=Ca(OH)2 BaO+H2O=Ca(OH)2 Na2O+H2O=2NaOH K2O+H2O=2KOH
c.注意:CO和H2 O既不是酸性氧化物也不是碱性氧化物,是不成盐氧化物。
9.酸:电离时生成的阳离子全部是氢离子的化合物。酸溶液的PH值小于7
酸的名称中最后一个字是“酸”,通常化学式的第一种元素是“H ”,酸由氢和酸根离子组成
紫色石蕊试液遇酸变红色,无色酚酞试液遇酸不变色
1.
根据酸的组成,通常有以下两种分类方法:酸的电离方程式:酸=nH+ +酸根离子n-

鉴定酸(鉴定H+ )的方法有:①加紫色石蕊试液变红色的是酸溶液;
②加活泼金属Mg、Fe、Zn等有氢气放出
1碱:电离时生成的阴离子全部是氢氧根离子的化合物。碱通常由金属离子和氢氧根离子构成。溶碱有五种:钾钙钠钡氨(KOH,Ca(OH)2 ,NaOH Ba(OH)2 ,氨水)它们的溶液无色。
有颜色的碱(不溶于水):红褐色的氢氧化铁(Fe(OH)3 ↓ )、蓝色的氢氧化铜(Cu(OH)↓)
其他固体碱是白色。碱的名称通常有“氢氧化某”,化学式的最后面是“OH”
可溶性碱的溶液PH值大于7,紫色石蕊试液遇溶碱变蓝色,无色酚酞试液遇溶碱变红色
鉴定可溶性碱溶液(鉴定OH- )方法一:加紫色石蕊试液变蓝色,加无色酚酞试液变红色是碱. 方法二:加铁盐溶液有红褐色沉淀生成;加铜盐溶液有蓝色沉淀的是碱。
11.盐:电离时生成金属离子和酸根离子的化合物。 第一种分类方法:
a.正盐(酸碱完全中和的产物,没有可电离的氢离子或氢氧根离子),例如 NaCl、Na2 S ,KNO3
无氧酸正盐叫 “某化某”Na2 S_______ MgCl2__________FeS__________
含氧酸盐叫“某酸某”KNO3_________ BaSO4______________Na2CO3______
b.酸式盐(多元酸里的氢部分被金属取代,H夹在中间)
NaHCO3____________ 、 Ca(HCO3 )2_____________、NaH2 PO4 _____________
常见的酸式盐的酸根有:HCO3 - 、HSO4 - 、H2 PO4 - 、HPO4 2-
c.碱式盐(化学式的中间有“OH”):Cu2 (OH)2 CO3
第二种分类方法
按盐中相同部分的离子称为某类盐:含碳酸根离子的盐称为碳酸盐、含硫酸根离子的盐称为
硫酸盐、含硝酸根离子的盐称为硝酸盐、含铁离子的盐称为铁盐,等等。
12.酸碱指示剂(石蕊试液、无色酚酞)和PH值:
酸溶液的PH值小于7(如盐酸、稀硫酸、硝酸),酸性越强PH值越小,酸性越弱PH值越大。水、中性的硫酸盐、硝酸盐和盐酸盐溶液不能使指示剂变色,PH值等于7。不能使指示剂变色;可溶的碱溶液PH值大于7。碱性越强PH值越大,碱性越弱PH越小
13.酸碱盐溶解性口诀:钾钠硝铵溶 溶碱有五种 :钡钾钙钠氨
不溶氯化物AgCl 不溶硫酸盐BaSO4 碳酸盐只溶钾钠铵
口诀的含义:含有钾、钠、硝酸根、铵根的物质都溶于水
溶于水的碱有:氢氧化钡、氢氧化钾、氢氧化钙、氢氧化钠 和氨水,其他碱不溶于水
含Cl的化合物只有AgCl不溶于水,其他都溶于水;含SO42- 的化合物只有BaSO4 不溶于水,其他都溶于水。含CO32- 的物质只有含K+ Na+ NH4+溶于水,其他都不溶于水
14.沉淀物中AgCl和BaSO4 不溶于稀硝酸,Fe(OH)3是红褐色沉淀,Cu(OH)2是蓝色沉淀
其他沉淀是白色(包括Fe(OH)2)有以下常见的沉淀:Mg(OH)2 Al(OH)3 CaCO3 BaCO3 Ag2 CO3
推断题中,往沉淀物加稀硝酸:若讲沉淀不溶解,则沉淀中一定有AgCl或BaSO4 ;若讲沉淀
全部溶解,则沉淀中一定没有AgCl或BaSO4 ;若讲沉淀部分溶解,则沉淀中一定有AgCl或BaSO4 中的一种,且还有另一种可溶于稀硝酸的沉淀。
(三)分子、原子、离子、元素和化学式
15. 元素:具有相同核电荷数(即核内质子数)的一类原子总称元素。
原子的核电荷数(即核内质子数)决定原子或离子的元素种类。
①大部分单个的元素符号表示:一种元素、该元素的一个原子、一种单质
但H N O Cl等符号不能表示单质,它们的单质是:H2 N2 O2 Cl2
②地壳中元素按质量分数由多至少前四位是:O氧 Si硅 Al铝 Fe铁。铝是地壳中含量最多的金属元素。 ③化学的“语法”: “某分子”由“某原子构成”。“某物质”由“某元素组成”或“某某分子构成”(金属单质、稀有气体讲由某原子直接构成)
例:水由氢元素和氧元素组成,水由水分子构成。1个水分子由2个氢原子和1个氧原子
构成元素、物质都是宏观概念,只表示种类,不表示个数。不能说“水是由二个氢元素和一个氧元素组成”
④具有相同核电荷数的粒子不一定是同种元素,下列粒子有相同的核电荷数:
⑴ H2 和He ⑵ CO、N2 和Si ⑶ O2 、S和 S2- ⑷ OH- 和 F-
元素、分子和原子的区别与联系
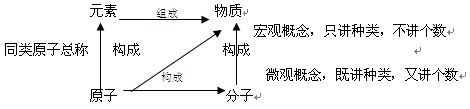
16.粒子:如原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。金属单质和稀有气体由原子直接构成;
非金属单质、非金属与非金属形成的共价化合物由分子构成,化合物中既有金属元素又有
非金属元素的离子化合物是由离子构成。
17.分子:分子是保持物质化学性质的最小粒子。分子由原子构成, 例:1个水分子由2个氢原子和1个氧原子构成
18.原子:原子是化学变化中的最小粒子。(注意:原子不是构成物质的最小粒子。)
原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子
和不带电的中子构成。 在不显电性的粒子里: 核电荷数=质子数=核外电子数
注意:原子不是构成物质的最小粒子。原子只是化学变化中的最小粒子;
普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。
分子和原子的区别:在化学变化中分子可分为更小的粒子---原子,原子不能再分。
物质发生物理变化时只是分子间的间隔发生变化,而分子本身没有发生变化;发生化学变化时,
分子被破坏,分子本身发生变化。
在一切化学反应中,反应前后元素的种类、原子的种类、原子的数目和原子的质量都不变。
19.原子团:由两种或两种以上元素的原子构成,在化学反应中通常以整体参加反应的原子集团
常见的原子团:SO42- CO32- NO3- OH- MnO4- MnO42- ClO3- PO43- HCO3- NH4+碳酸氢根(HCO3-)硫酸氢根(HSO4-)磷酸氢根(HPO42-)磷酸二氢根(H2PO4-)
注意:原子团只是化合物中的一部分,不能脱离物质单独存在,因此含原子团的物质必定有三种
或三种以上元素,二种元素组成的物质不含原子团。原子团在化学反应中可再分为更小的粒子原子。
20.离子:带电的原子或原子团叫离子。带正电的离子叫阳离子;带负电的离子叫阴离子。
离子里:质子数=核电荷数=电子数±带电量
离子符号的写法:离子的电荷数标在右上角,电荷的数值等于它对应的化合价
阳离子:Na+ Mg2+ Al3+ 、H+ NH4+、Fe2+ Fe3+ Ca2+
阴离子:O2- OH- S2- F2- Cl- SO4 2- CO32- NO3- MnO4- MnO42- ClO3-
21.核外电子排布的规律:核外电子按能量由低到高从里往外排,第一层最多容纳2个电子,
第二、三层最多容纳8个电子。 按顺序背诵:质子数从1~18的元素符号和名称:
氢氦锂铍硼 碳氮氧氟氖 钠镁铝硅磷 硫氯氩
22.稳定结构:最外层电子数是8(只有一层的为2)的结构。元素的化学性质跟原子的最外层电子数关系最密切,原子的最外层电子数决定元素的化学性质:
最外层电子数小于4时,易失去最外层所有电子,成为阳离子;(通常是金属元素)
最外层电子数多于4时,易得到电子使最外层电子数变为8,成为阴离子(通常是非金属元素)
最外层电子数与化合价的关系:(元素的最高正价等于原子的最外层电子数)
最外层电子数小于4时,最外层电子数就是元素的化合价(正价);
最外层电子数多于4时,最外层电子数-8=元素的化合价
23. 化学式的写法: ① 单质的化学式:大部分单质的化学式只用单个的元素符号,
下面几种元素的单质不能只用单个的元素符号表示,须注意:
氢气H2 氧气O2 氮气N2 氯气Cl2 氟气F2 溴(Br2 ) 碘(I2 )臭氧O3
②化合物的化学式写法与读法的一般关系:“倒写倒读”。
化合价与化学式(交叉法确定化学式:正价在前负价在后,约简化合价,交叉)
NH3、有机物如 CH4等化学式是负价在前正价在后。 同种元素可以有不同的化合价
硝酸铵(NH4 NO3 )中氮元素的化合价分别为前N-3价 ,后N+5价。
24.元素的化合价:一种元素一定数目的原子与另一种元素一定数目的原子化合的性质。
标在元素符号的正上方
+2 -2 +1
Ca +2价的钙元素 O -2价的氧元素 H2O 水中氢元素化合价是+1价
背诵化合价口诀:
+1价钾钠银铵氢, +2价钡钙镁铜汞锌
二三铁、二四碳, 三铝四硅五价磷,
氟、氯、溴、碘-1价 氧硫-2要记清。
氢氧根、硝酸根(OH、NO3 )-1价, 硫酸根、碳酸根(SO4 、CO3 )-2价,
化合物各元素化合价代数和为零, 单质元素化合价是零。
注:铵是NH4原子团;+ 2价的铁叫“亚铁”; +1价的铜叫“亚铜”
无氧时S为-2价,跟氧结合时+4或+6价。SO32-原子团叫“亚硫酸根”
无氧时Cl为-1价,跟氧结合时+1、+3、+5或+7价
25.相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。 相对原子质量=×12 (相对原子质量是个比,单位为1) 相对原子质量≈质子数 +中子数
26. 化学反应基本类型
①化合反应:A+B+...=C 两种或两种以上的物质生成另一种物质的反应
②分解反应:A=B+C+... 一种物质生成两种或两种以上其他物质的反应
③置换反应:一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应
A+BC=AC+B 溶液里的置换反应必须符合金属活动性顺序:
金属活动性顺序由强至弱:Ba K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
(按顺序背诵) 钡 钾钙钠镁铝 锌铁锡铅(氢) 铜汞银铂金
金属位置越靠前的活动性越强,越易失去电子变为离子,反应速率越快
排在氢前面的金属能置换酸里的氢,排在氢后的金属不能置换酸里的氢,跟酸不反应;
排在前面的金属,能把排在后面的金属从它们的盐溶液里置换出来。排在后面的金属跟
排在前面的金属的盐溶液不反应。 注意:单质铁在置换反应中总是变为+2价的亚铁
等质量金属跟足量酸反应,放出氢气由多至少的顺序按相对原子质量/化合价由小到大排列:Al(9) Mg(12) Ca(20) Na(23) Fe(28) Zn(32.5) K(39)
④复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应,
复分解反应前后各元素和原子团的化合价都保持不变。
注意事项:复分解反应能否发生,要考虑是否有沉淀、气体或水生成。有沉淀生成的反应中,
反应物和生成物中不能同时有难溶于水的物质。初中化学只有碳酸盐跟酸反应有气体生成
中和反应:酸跟碱作用生成盐和水的反应。中和反应属于复分解反应。
27.我国古代在化学方面的杰出贡献主要有:造纸术、火药、烧瓷器
28.氧化反应:物质跟氧发生的化学反应(或得到氧的化学反应),不是一种基本反应类型。
缓慢氧化:缓慢进行不易被人觉察的氧化反应。如铁生锈、呼吸作用、食物腐败
燃烧必备的二条件:①可燃物与氧气接触,②温度达到着火点
自燃:由缓慢氧化积聚的热量引发的自发燃烧。白磷着火点低,易自燃,要放在水中密封保存。
还原反应:物质失去氧的反应。(氧化反应和还原反应不是基本反应类型)
还原剂:在化学反应中得到氧的物质。常用的还原剂有H2 、CO、C等, 具有还原性。
29.催化剂(触媒): 在化学反应里能改变其他物质的化学反应速率,而本身的质量和化 学性质在化学反应前后都没有改变的物质。 催化作用:催化剂在化学反应里所起的作用叫催化作用。
注意:二氧化锰只是在氯酸钾分解的反应里作催化剂,在其他反应里可能不是催化剂
30. 书写化学方程式①依据:质量守恒定律:参加化学反应的各物质质量总和,等于反应后生成的各物质质量总和。( 在一切化学反应中,反应前后元素的种类、原子的种类、各类原子的数目和原子的质量都不变)②书写化学方程式的步骤: 化学式写正确,方程式要配平,条件箭头要标明。
③遵守二原则:一是以客观事实为基础,不能随便臆造化学反应和化学式;
二是遵守质量守恒定律,等号两边的各种原子数目必须相等
(四)溶液、溶解度
31.溶液:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物。
溶液由溶质和溶剂组成。(在溶液里的反应,一般是溶质参加反应)
32.溶质:被溶解的物质叫溶质(可以是气体、液体或固体),但没有溶解的物质不是溶液的一部分,不能认为是溶质。例:20℃时,50克食盐放入100水中,没有溶解的24克食盐不是溶质,不是溶液的一部分
33.溶剂:能溶解其他物质的物质叫溶剂。溶剂通常是液体,不指明溶剂的溶液其溶剂是水。
34.饱和溶液:在一定的温度下,一定量的溶剂里,不能再溶解某种溶质溶液叫做
这种溶质的饱和溶液。( 蒸发溶剂有晶体析出,剩余溶液一定是饱和溶液)
35.不饱和溶液:在一定温度下,一定量的溶剂里,还能继续溶解某种溶质的溶液叫做
这种溶质的不饱和溶液。注意:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
同种溶质在同一温度下,饱和溶液比不饱和溶液的浓度大
36.饱和溶液与不饱和溶液的相互转化
一般情况下:向饱和溶液加溶剂或升高溶液温度可使饱和溶液变为不饱和溶液;
向不饱和溶液加溶质、降低溶液温度、蒸发溶剂可使不饱和溶液变为饱和溶。

37.固体的溶解度:在一定温度下,某固态物质在100克溶剂达到饱和状态时所溶解
的质量,叫做这种物质在这种溶剂里的溶解度。
(关键词:一定的温度 100克溶剂 达到饱和状态 溶质质量)
38.溶解度曲线:物质的溶解度随温度变化的曲线。
大部分固体的溶解度随温度升高 而增大,但NaCl的溶解度受温度影响很小,
熟石灰的溶解度随温度高而减小。气体的溶解度随温度降低、压强的增大而增大。
39.固体溶解度与溶解性的关系:
|
溶解性 |
易溶 |
可溶 |
微溶 |
难溶(或不溶) |
|
20℃的溶解度(克) |
>10 |
1~10 |
0.01~1 |
<0.01 |
常见难溶于水的物质有:大部分金属、金属氧化物、BaSO4、AgCl、CaCO3等碳酸盐
40.混合物的分离:把混合物里的各种物质分开,得到混合物中每一组分的纯净物。
常用的物理方法有:溶解、过滤、结晶等
化学方法是:通过化学反应,使某些组分变为与原物质不同状态的物质而分开
41.结晶:从溶液里得到有一定几何形状的晶体的过程叫结晶。
结晶方法:①蒸发溶剂结晶(适用于溶解度受温度影响小的固体,如NaCl)
从盐水中得NaCl固体可采用蒸发溶剂的方法。
②冷却热的饱和溶液结晶(适用于溶解度受温度影响大的固体,如硝酸钾)
此方法还可分离硝酸钾和氯化钠的混合物,得较纯的硝酸钾晶体。
(五)电离
42.溶液的导电性:物质溶于水发生电离使溶液能导电。(纯水、固体酸碱盐不导电)
43.电离:物质溶于水时,离解成可自由移动的离子的过程叫电离。
注意 ①电离是自发的过程,不须通电。②在溶液里所有阳离子所带的正电荷总数
和所有阴离子所带的负电荷总数相等,所以溶液不显电性。但阳离子的个数不一定等于阴离子的个数
44.电离方程式的书写注意:①离子电荷数等于它对应的化合价数值②原子团不能拆散
Ax By =xAy+ +yBx- Ax(ROn )y =xAy+ +yROn x-
相关推荐
以上就是本文的全部内容,更多精彩内容,请持续关注长春新东方网。

新东方长春学校官方微信:新东方长春学校 (微信号:ccxdfcn)
最新考试资讯、考试政策解读、真题解析,请扫一扫二维码,关注我们的官方微信!
相关推荐
版权及免责声明
①凡本网注明"稿件来源:新东方"的所有文字、图片和音视频稿件,版权均属新东方教育科技集团(含本网和新东方网) 所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他任何方式复制、发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:新东方",违者本网将依法追究法律责任。
② 本网未注明"稿件来源:新东方"的文/图等稿件均为转载稿,本网转载仅基于传递更多信息之目的,并不意味着赞同转载稿的观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:新东方",本网将依法追究法律责任。
③ 如本网转载稿涉及版权等问题,请作者见稿后在两周内速来电与新东方网联系,电话:010-60908555。