新东方网>长春新东方学校>优能中学>优能初中>中考资讯>正文
中考化学复习元素及其化合物
2016-06-16 09:28
来源:新东方
作者:新东方
中考化学复习元素及其化合物由长春新东方同步新东方整理发布,更多精彩内容,请持续关注长春新东方官方网站及长春新东方学校公众号【ccxdfcn】。
二、元素及其化合物
(一)水
1.水、蒸馏水是纯净物、化合物和氧化物。矿泉水、海水、河水、糖水和盐水属于混合物
2. 污染水质的因素:工业生产中的废渣、废水、废气(即“三废”)和生活污水的任意排放,
农业生产中施用的农药、化肥随雨水流入河流。
3.电解水实验(水中加少量硫酸或NaOH,增强水的导电性) ``通电
① 水通电(正极O2 负极H2 ,体积比1:2) 2H2 O==2H2 ↑ + O2 ↑
②证明物质里是否含水方法:白色的无水硫酸铜遇水变蓝色
(二)空气
4.空气的成分按体积分数计算:氮气78%,氧气21%,稀有气体0.94%,CO2 0.03%
5.环境污染知识:排放到空气中的气体污染物较多的是二氧化硫、二氧化氮、一氧化碳
6.测定空气成份或除去气体里的氧气,要用易燃的磷,磷燃烧后生成固体,占体积小易分离。
不能用碳、硫代替磷。碳、硫跟氧气反应生成气体,难跟其他气体分离。
( 三)氧气的性质和用途
7.氧气的物理性质:不易溶于水,密度比空气的略大。液氧、固态氧淡蓝色。
8.氧气的用途:气焊、航天、潜水、登山、医疗、液氧炸药、炼铁、炼钢
9.氧气的化学性质:支持燃烧,有助燃性。可供呼吸用,是常用的氧化剂。
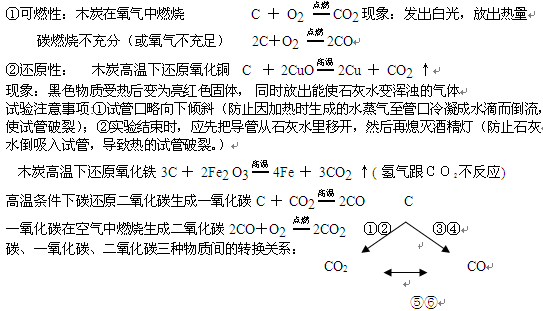
⑴木炭在氧气中燃烧(O2可使带火星的木条的木条复燃)C+O2点燃CO2
现象:发出白光,放出热量,生成使石灰水变浑浊的气体
⑵硫在空气中燃烧,硫在氧气中燃烧 S + O2 点燃 SO2
硫在空气里燃烧发出微弱的淡蓝色火焰,产生有刺激性气味的气体,放出热量;
在氧气里燃烧发出蓝紫色火焰,产生有刺激性气味的气体;放出热量
⑶磷在空气中燃烧 4P + 5O2点燃2P2 O5
现象:发出白光,产生大量的白烟,放出热量
白磷着火点低,易自燃,要放在水中密封保存,可隔绝空气,防止它自燃。
⑷镁在空气(或氧气)中燃烧 2Mg + O2点燃 2MgO
现象:发出耀眼的白光,放出热量,生成白色固体
⑸铁丝在氧气中燃烧 3Fe + 2O2 点燃 Fe3 O4
现象:剧烈燃烧,火星四射,生成黑色固体,放出热量
此实验必须先在集气瓶里装少量水或在瓶底铺一层细砂,防止溅落的熔化物使瓶底炸裂
⑹氢气在空气中燃烧(点燃爆鸣气) 2H2 + O2点燃2H2 O
现象:纯净的氢气在空气里安静地燃烧,发出淡蓝色火焰,放出热量; 不纯的氢气点燃会爆炸
⑺蜡烛在氧气里燃烧得更旺,发出白光,放出热量,瓶壁内有水珠。 向瓶内倒入澄清的石灰水,石灰水变浑浊。
⑻ 加热碱式碳酸铜 (俗称铜绿)Cu2 (OH)2 CO32CuO + H2 O + CO2 ↑
(现象:绿色粉末变黑色,管壁有水珠,生成的气体使澄清的石灰水变浑浊)
(四)氧气的制法:
10.工业制取氧气的方法:分离液态空气制取氧气,此变化是物理变化,不是分解反应
实验室制取氧气反应原理:
①加热高锰酸钾 2KMnO4 加热K2 MnO4 + MnO2 + O2 ↑
②加热氯酸钾和二氧化锰的混合物 2KClO3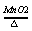 2KCl + 3O2 ↑
2KCl + 3O2 ↑
实验室制取氧气注意事项:
①试管口略向下倾斜(防止因加热时药品所含湿气变为水蒸气,至管口冷凝成水滴而倒流,使试管破裂);②用排水法收集氧气,导管口开始有气泡放出时不宜立即收集,当气泡连续地较均匀地放出后再收集(因为开始放出的气泡不纯,含有空气)③排水法收集氧气结束时,应先撤去导管,后停止加热(防止水倒吸入试管,导致热的试管破裂。)其他生成氧气的反应: `③水通电(正极O2 负极H2 ,体积比1:2) 2H2 O通电 2H2 ↑ + O2↑
④加热氧化汞 2HgO 2Hg + O2 ↑
2Hg + O2 ↑
(五)氢气的性质和用途
11.氢气的性质(1)物理性质:密度最小的气体,难溶于水
(2)化学性质 : ①可燃性:氢气在空气中燃烧 2H2 + O2点燃2H2 O
现象:纯净的氢气在空气里安静地燃烧,发出淡蓝色火焰,放出热量
不纯的氢气点燃会爆炸,所以点燃氢气前一定要先检验氢气的纯度。
②还原性:氢气还原氧化铜 H2 +CuO Cu+H2 O
Cu+H2 O
现象:黑色氧化铜逐渐光亮的红色的铜,管壁有水珠产生
氢气还原氧化铜实验注意事项:“酒精灯迟到早退”,即开始时要先通入氢气后加热(目的是排净管内空气,防止氢气与管内空气混合受热发生爆炸);实验结束时要先停止加热,继续通入氢气至试管冷却(防止生成的铜受热被氧化成CuO)
(3)氢气的用途:充气球,冶炼金属,高能燃料,化工原料
12.生成氢气的反应(实验室制取H2最常用的试剂是:锌粒和稀硫酸,也可用②③⑤⑥⑦)
① 锌粒和稀硫酸反应 Zn + H2 SO4=ZnSO4+H2↑ ②铁和稀硫酸反应
Fe+H2 SO4=FeSO4 + H2 ↑
③镁和稀硫酸反应 Mg+H2 SO4=MgSO4+H2↑ ④铝和稀硫酸反应
2Al+3H2 SO4=Al2(SO4)3+3H2↑
⑤锌粒和盐酸反应 Zn +2HCl=ZnCl2 + H2 ↑⑥铁和盐酸反应Fe+2HCl=FeCl2+H2↑
⑦镁和盐酸反应 Mg + 2HCl=MgCl2+H2↑⑧铝和盐酸反应 2Al+6HCl=2AlCl3+3H2↑
(六)铁的性质
13.铁的物理性质:有银白色金属光泽的固体,有良好的延性和展性,质软,是导体
铁的化学性质:(1)铁跟氧气反应
铁在潮湿的空气里(既有H2O又有O2时)易生锈,铁锈是混合物,主要成分是氧化铁Fe2 O3
防锈方法:在铁表面涂一层保护膜(如涂漆或油);镀锌等金属或烤蓝
铁在氧气里燃烧生成四氧化三铁,剧烈燃烧,火星四射,生成黑色固体,放出热量
(2) 铁可跟酸和排在铁后的金属的盐溶液发生置换反应(反应后溶液呈浅绿色)
① 铁跟硫酸铜溶液反应(现代湿法冶金的先驱)化学方程式:Fe+CuSO4=Cu+FeSO4
现象:铁丝表面覆盖一层红色的铜, 反应后溶液呈浅绿色
②铁跟硫酸反应Fe+H2 SO4=FeSO4 + H2 ↑ 铁跟盐酸反应Fe+2HCl=FeCl2 + H2 ↑
现象:有气泡生成,反应后溶液呈浅绿色(铁有两种离子:铁离子Fe3+ 亚铁离子Fe2+)
铁元素有三种氧化物:氧化铁Fe2O3 氧化亚铁FeO 四氧化三铁Fe3O4
14.生铁和钢:都是铁的合金,区别是含碳量不同,生铁的含碳量高,钢含碳量低。
合金:金属与金属(或非金属)熔合而成,具有金属性质的混合物。(纯净物不是合金)
(七)单质碳的性质
15.金刚石和石墨是由碳元素组成的两种不同的单质,它们物理性质不同、化学性质相同。
它们的物理性质差别大的原因碳原子的排列不同
16.碳的化学性质跟氢气的性质相似(常温下碳的性质不活泼)
(八)二氧化碳的性质
17.二氧化碳的物理性质:可溶于水,密度比空气的大。加压降温易变为固体“干冰
用途:灭火,温室里作肥料,干冰用于致冷和人工降雨,化工原料
18.二氧化碳的化学性质
①跟水反应:二氧化碳通入水中生成碳酸 CO2 + H2 O =H2 CO3
二氧化碳通入紫色石蕊试液,石蕊试液变红色;加热又变为紫色
②跟碱反应生成盐和水:(用澄清的石灰水鉴定CO2)
二氧化碳通入澄清的石灰水 CO2 + Ca(OH)2 = CaCO3 ↓+H2 O
现象:有白色沉淀生成(或:澄清的石灰水变浑浊)
二氧化碳跟氢氧化钠反应:CO2 + 2NaOH= Na2 CO3 +H2 O(无明显现象)
③通常情况下,CO2不支持燃烧,也不能燃烧。
(九)一氧化碳的性质
19.一氧化碳的物理性质:无色、无味、比空气的密度略小、难溶于水
20.一氧化碳的化学性质
① 可燃性: 一氧化碳在空气中燃烧生成二氧化碳 现象:发出蓝色火焰,放出热量 2CO+O2 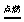 2CO2
2CO2
②还原性:一氧化碳还原氧化铜(不是置换反应) CO + CuO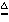 Cu + CO2
Cu + CO2
现象:黑色物质受热后变为亮红色固体, 同时放出能使石灰水变浑浊的气体
特别注意尾气的处理:一氧化碳有剧毒,会使空气受污染,必须把未反应的CO燃 烧转变成无污染的CO2 △
一氧化碳还原氧化铁 3CO + Fe2 O3 高温2Fe + 3CO2
③毒性:一氧化碳吸入肺里跟血液的血红蛋白结合,破坏了血红蛋白的输氧能力
三种有可燃性、还原性的物质:氢气、碳、一氧化碳(都可用于冶炼金属、用作燃料)
(十)碳酸钙的性质和用途
21.碳酸钙主要以石灰石和大理石存在,大理石和石灰石主要成分是CaCO3 。大理石和石灰石做建 筑材料,工业上用石灰石制生石灰(CaO)和二氧化碳、制水泥。
22.碳酸钙的物理性质:白色固体,难溶于水。 化学性质:
①跟盐酸、硝酸反应(碳酸钙不溶于水,可溶于酸)
CaCO3 +2HCl=CaCl2 +H2 O+CO2 ↑ (实验室制取CO2的反应)
CaCO3 +2HNO3 =Ca(NO3 )2 +H2 O+CO2 ↑

甲醇(CH3OH)有毒,不能饮用,饮用后使人双目失明,大量饮用会使人死亡。
25.煤(主要含碳元素,称为“工业的粮食”)、石油(主要含碳元素、氢元素,称为“ 工业的
血液”)天然气(主要成分是CH4),三种最重要的矿物燃料,都是混合物
(十二)酸 碱 盐 氧化物
第八章学到的三大系列物质
同系列内的物质间一般不反应,但可在适当条件下相互转化
系列一 系列二 系列三
金属 非金属
↓O2 ↓O2
金属氧化物 非金属氧化物
碱性氧化物 酸性氧化物
↓H2O 盐 ↓H2O
碱 酸
碱的通性 酸的通性
①紫色石蕊试液遇碱变蓝色, ①紫色石蕊试液遇酸变红色,
无色酚酞试液遇碱变红色 无色酚酞试液遇酸不变色
②氢前的金属+酸→盐+H2 ↑
注意:浓硫酸、硝酸跟金属反
应不生成氢气,生成水
②碱+酸性氧化物→盐+水 ③酸+碱性氧化物→盐+水
③碱+酸→盐+水(“中和反应”) ④酸+碱→盐+水(“中和反应”)
④碱+盐→另一种碱+另一种盐 ⑤酸+盐→另一种酸+另一种盐
碱的通性的①②④项的碱必须是可溶于水 碳酸盐+酸→盐+H2O + CO2 ↑
盐的通性(盐的通性中(1)(3)(4)项的盐必须是可溶于水)
⑴金属+盐→金属+盐(必须符合金属活动性顺序规律)
⑵酸+盐→酸+盐 碳酸盐+酸→盐+H2O + CO2 ↑
⑶盐1+碱1→盐2+碱2 参加反应的盐和碱都必须是可溶于水
⑷盐1 +盐2 →盐3 +盐4参加反应的盐都必须是可溶于水且符合复分解反应的规律)
26.氧化物的性质:
①有四种碱性氧化物跟水反应生成碱,其他的碱性氧化物不溶于水跟水不反应
Na2 O+H2 O=2NaOH CaO+H2 O=Ca(OH)2
K2 O+H2 O=2KOH BaO+H2 O=Ba(OH)2
②酸性氧化物:大部分非金属氧化物都是酸性氧化物,跟水化合生成同价的含氧酸。
CO2 +H2 O=H2 CO3 SO2 +H2 O=H2 SO3 SO3 +H2 O=H2 SO4
27.盐酸和硫酸用途:硫酸和盐酸可除去金属表面的锈,都是重要的工业原料
盐酸(氢氯酸,HCl气体的水溶液,无色液体) 浓盐酸有挥发性,会挥发出HCl
硫酸(H2 SO4 ) 浓硫酸有吸水性,可作气体的干燥剂
28.浓硫酸的稀释:稀释浓硫酸时,必须把浓硫酸沿着容器壁慢慢地注入水里,并不 断搅拌,使产生的热量迅速扩散,切不可把水倒入浓硫酸里。
|
酸 |
盐酸 |
硫酸 |
||
|
物理性质 |
挥发性 在空气中产生白雾 |
浓硫酸有吸水性 |
||
|
化
学
性
质 |
证明是酸的方法 |
①石蕊试液 |
石蕊试液遇盐酸:变红色 |
石蕊试液遇硫酸:变红色 |
|
无色酚酞遇盐酸:不变色 |
无色酚酞遇硫酸:不变色 |
|||
|
②跟金属反应 |
Zn +2HCl=ZnCl2+H2↑ Fe+2HCl=FeCl2+H2↑ |
Zn +H2SO4=ZnSO4+H2↑ Fe +H2SO4=FeSO4+H2↑ |
||
|
跟金属氧化物 反应 |
氧化铁
|
固体溶解,溶液变黄色 |
固体溶解,溶液变黄色 |
|
|
Fe2O3+6HCl=2FeCl3+3H2O |
Fe2O3+ 3H2SO4=Fe2(SO4)3+ 3H2O |
|||
|
氧化铜 |
固体溶解,溶液由无色变蓝色 |
固体溶解,溶液由无色变蓝色 |
||
|
|
|
|||
|
跟碱反应的方程式现象 |
氢氧 化铁 |
固体溶解,溶液变黄色 |
固体溶解,溶液变黄色 |
|
|
|
|
|||
|
氢氧 化铜
|
固体溶解,溶液由无色变蓝色 |
固体溶解,溶液由无色变蓝色 |
||
|
|
|
|||
|
跟碳酸盐反应 |
碳酸钠 |
|
|
|
|
碳酸钙 |
|
|
||
|
检验Cl-、SO42- |
方法 |
Cl-:加硝酸银溶液,再加硝酸 |
SO42-: |
|
|
现象 |
有不溶于硝酸的白色沉淀生成 |
有不溶于硝酸的白色沉淀生成 |
||
|
方程式 |
|
|
||
|
此类反应必须加稀硝酸,以消除CO32-、OH-对实验的影响。 |
||||
盐酸(或氯化物)和硫酸(硫酸盐)的区别方法:最好用可溶性钡的化合物氯化钡 (硝酸钡或
氢氧化钡),有白色沉淀生成的是硫酸(硫酸盐),无现象的是盐酸
不能用硝酸银溶液,因硝酸银跟硫酸反应有硫酸银白色沉淀生成。
29.硝酸(HNO3 )有酸的通性,但跟金属反应不生成氢气 磷酸H3 PO4
30.氢氧化钠(俗名:烧碱、火碱、苛性钠 化学式:NaOH)
物理性质: 白色固体,极易溶于水且放出大量热,有吸水性,易潮解由于氢氧化钠易潮解,称量时必须放在玻璃器皿(如烧杯、表面皿)里称量。NaOH会吸收空气中的水分,又会跟二氧化碳反应,所以必须密封保存
用途:作中性或碱性气体的干燥剂,不能干燥二氧化硫、二氧化碳、氯化氢,
可干燥H2、O2、N2、CO、NH3 CH4等;用于肥皂、石油、造纸等工业
化学性质:(KOH的化学性质跟NaOH相同)
①二氧化碳、二氧化硫分别通入氢氧化钠溶液里(无明显现象)
CO2+2NaOH=Na2CO3+H2O SO2+2NaOH=Na2SO3+H2O SO2+2NaOH=Na2SO4+H2O
②硫酸和硝酸分别跟氢氧化钠溶液发生中和反应(无明显现象)
③氢氧化钠跟盐反应
a. 氢氧化钠溶液跟氯化铁、硫酸铁、硝酸铁溶液的现象和方程式:
现象有红褐色沉淀生成:6NaOH+Fe2(SO4)3=3Na2SO4+2Fe(OH)3↓
b. 氢氧化钠溶液跟氯化铜、硫酸铜、硝酸铜溶液的现象和方程式:
现象有蓝色沉淀生成:2NaOH+CuSO4=Na2SO4+Cu(OH)2↓
c. 氢氧化钠溶液跟氯化镁、硫酸镁、硫酸铝溶液的现象有白色沉淀生成
方程式:2NaOH+MgSO4=Na2SO4+Mg(OH)2↓
31.氢氧化钙(俗名:消石灰、熟石灰 化学式Ca(OH)2 )
白色固体,微溶于水,溶解度随温度升高而降低。用生石灰跟水反应制得。
用途:与硫酸铜配制农药“波尔多”液,可用来降低土壤酸性,制建筑业的三合土
氢氧化钠和氢氧化钙不同点:氢氧化钙跟二氧化碳、碳酸钠、碳酸钾反应
有白色沉 淀生成,氢氧化钠则无沉淀生成。
CO2+ Ca(OH)2=CaCO3↓+H2O Na2CO3+ Ca(OH)2 =CaCO3↓+2NaOH
写出下列转变的化学方程式:CaCO3→CaO→Ca(OH)2→CaCO3
32.常见的盐
a.氯化钠(NaCl 食盐的主要成分) NaCl+AgNO3 =NaNO3 +AgCl↓
粗盐提纯的步骤:1.溶解 2.过滤 3.蒸发 4.称量并计算粗盐的产率。
实验仪器:药匙、烧杯、玻璃棒、蒸发皿、漏斗、量筒、酒精灯、
b.碳酸钠(俗名:纯碱,Na2 CO3 类别:盐,正盐 不是碱)
①碳酸钠+酸→盐+H2 O + CO2 ↑ 例: Na2 CO3 +2HNO3 =2NaNO3 +H2 O+CO2 ↑
②2AgNO3 +Na2 CO3 =2NaNO3 +Ag2 CO3 ↓ ③CaCl2 +Na2 CO3 =2NaCl+ CaCO3 ↓
④BaCl2 +Na2 CO3 =2NaCl+ BaCO3 ↓ ⑤Ca(OH)2 +Na2 CO3 =2NaOH+ CaCO3 ↓
c.硫酸铜(硫酸铜晶体俗名:蓝矾、胆矾)
①加热蓝色硫酸铜晶变为白色 无水硫酸铜是白色固体,遇水变蓝色
CuSO4·5H2O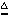 CuSO4 +5H2O ↑ CuSO4 +5H2O= CuSO4·5H2O
CuSO4 +5H2O ↑ CuSO4 +5H2O= CuSO4·5H2O
②硫酸铜溶液跟可溶性碱反应有蓝色沉淀生成物:CuSO4+2NaOH=Cu(OH)2↓+Na2 SO4
③置换反应Fe + CuSO4 =FeSO4 + Cu Zn + CuSO4 =ZnSO4 + Cu
相关推荐
以上就是本文的全部内容,更多精彩内容,请持续关注长春新东方网。

新东方长春学校官方微信:新东方长春学校 (微信号:ccxdfcn)
最新考试资讯、考试政策解读、真题解析,请扫一扫二维码,关注我们的官方微信!
相关推荐
版权及免责声明
①凡本网注明"稿件来源:新东方"的所有文字、图片和音视频稿件,版权均属新东方教育科技集团(含本网和新东方网) 所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他任何方式复制、发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:新东方",违者本网将依法追究法律责任。
② 本网未注明"稿件来源:新东方"的文/图等稿件均为转载稿,本网转载仅基于传递更多信息之目的,并不意味着赞同转载稿的观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:新东方",本网将依法追究法律责任。
③ 如本网转载稿涉及版权等问题,请作者见稿后在两周内速来电与新东方网联系,电话:010-60908555。