新东方网>长春新东方学校>优能中学>优能初中>中考资讯>正文
初中化学常见的酸和碱教案
2016-06-16 08:37
来源:新东方
作者:新东方
初中化学常见的酸和碱教案由长春新东方同步新东方整理发布,更多精彩内容,请持续关注长春新东方官方网站及长春新东方学校公众号【ccxdfcn】。
7.2 常见的酸和碱
【教学目标】
认知目标:
1.知道浓硫酸、浓盐酸的物理性质;了解盐酸、稀硫酸的主要化学性质及用途;
2.知道烧碱、消石灰、氨水的物理性质;了解氢氧化钠、氢氧化钙的主要化学性质和用途;
3.认识强酸和强碱的腐蚀性;浓硫酸和硝酸的强氧化性;
4.初步认识常见的复分解反应;
5.认识常见的酸、碱在生活、生产中的应用
能力目标:
1.初步学会应用科学探究的方法认识酸和碱的性质;
2.初步了解在探究过程中应用归纳、总结等科学手段
情感目标:从酸碱在生活生产应用,使学生了解其重要性
教学重点与难点:
1.浓盐酸、浓硫酸、浓硝酸的性质;稀盐酸、稀硫酸的化学性质;
2.碱的性质
3.复分解反应
探究实验
1. 浓硫酸、浓盐酸、浓硝酸的物理性质比较
2. 稀硫酸和稀盐酸的化学性质比较
知识整理:
复习:物质的分类
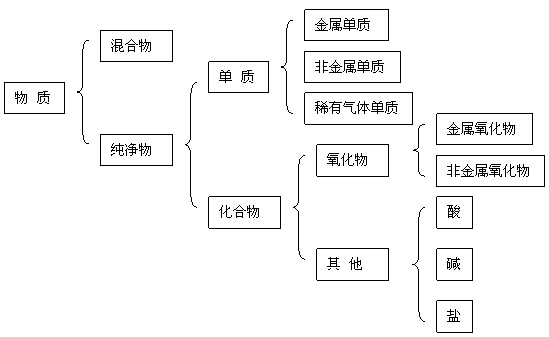
酸、碱、盐的概念
(1)酸:电离时生成的阳离子全部是氢离子的化合物。如:HCl、HNO3、H2SO4、H2CO3等。
HCl==H++Cl-;H2SO4==2H++SO42-;
电离通式:HnR==nH++Rn-;
(2)碱:电离时生成的阴离子全部是氢氧根离子的化合物。如:NaOH、Ca(OH)2等。
NaOH==Na++OH-;Ca(OH)2==Ca2++2OH-;
电离通式:R(OH)n==Rn++nOH-;
(3)盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物。如:NaCl、NH4NO3等。
NaCl==Na++Cl-;NH4NO3==NH4++NO3-;
一、常见的酸
1.生活中常用的酸:胃液中含有的盐酸(HCl),蓄电池中含有硫酸(H2SO4),酸雨中含有的硫酸及硝酸(HNO3),食醋中含有的醋酸(CH3COOH或HAc);饮料中可能含有的碳酸、柠檬酸等
2.酸的分类:无氧酸(如HCl)、含氧酸(HNO3)等
3.浓硫酸、浓盐酸和浓硝酸的物理性质
|
|
浓硫酸 |
浓盐酸 |
浓硝酸 |
|
溶质的化学式 |
H2SO4 |
HCl |
HNO3 |
|
颜色 |
无色 |
无色 |
无色 |
|
状态 |
粘稠、油状液体 |
液体 |
液体 |
|
气味 |
无味 |
刺激性气味 |
刺激性气味 |
|
浓度 |
98% |
36%~37% |
70% |
|
密度(与水比较) |
1.84g/mL |
1.17g/mL |
1.42g/mL |
|
敞开试剂瓶口发生的现象 |
无明显现象 |
产生白雾 |
产生白雾 |
|
是否具有挥发性 |
不易挥发 |
有挥发性 |
有挥发性 |
|
与水混合 |
放出大量的热 |
|
|
|
露置在空气中后的溶液质量 |
变大 |
变小 |
变小 |
|
露置在空气中后的溶质质量 |
不变 |
变小 |
变小 |
|
露置在空气中后的溶剂质量 |
变大 |
不变 |
不变 |
|
露置在空气中后的质量分数 |
变小 |
变小 |
变小 |
注意:浓硫酸具有一定的特性:
(1)吸水性(物理性质)用于气体干燥,但除NH3等碱性气体除外[2NH3 + H2SO4 == (NH4)2SO4]
(2)脱水性(化学性质)——黑面包实验(浓硫酸与蔗糖反应,使之炭化。)
(3)强氧化性,腐蚀性——与金属发生反应,不生成氢气而是水
在加热的条件下,能与排在氢后面的金属(如Cu)反应,如:
Cu+2H2SO4(浓)△==CuSO4+SO2↑+H2O
又如,浓硫酸与铁反应后,能生成一层致密的氧化膜,
(4)浓硫酸的稀释:酸入水,沿器壁,不断搅拌
浓硫酸溶于水放出大量的水,足以使水分沸腾,并且水的密度小于浓硫酸的密度。如果把水倒入浓硫酸中,水就会浮在浓硫酸上面,溶解时放出大量的热,致使水沸腾而使硫酸液滴向四周飞溅而造成事故。
(5)安全事故的处理:首先迅速用抹布将其擦拭,然后用大量水冲洗,最后用3%~5%的NaHCO3涂敷。
稀硫酸溅到皮肤上后,应该马上冲洗,因为随着稀硫酸中溶剂的蒸发,也会变成浓硫酸。
4.酸的化学性质
(1)实验:稀硫酸、稀盐酸、稀硝酸化学性质的比较
|
实验内容 |
现象与结论 |
||
|
稀硫酸 |
稀盐酸 |
稀硝酸 |
|
|
将镁条、锌粒、铜片分别放入酸溶液中 |
镁条、锌粒表面出现大量气泡,并且放镁条的试管底部明显发烫。 铜片表面没有明显变化。 |
现象与稀硫酸相似 |
注意:硝酸(包括浓硝酸和稀硝酸)与金属反应都不能产生氢气,因为其都具有强氧化性。 |
|
酸溶液分别于生锈的铁钉反应 |
铁锈逐渐消失,溶液逐渐变黄。过量的酸与铁钉反应,可能会有大量的气泡 |
现象与稀硫酸相似 |
|
|
酸溶液与石灰石作用 |
石灰石表面有大量的气泡,一会儿就马上停止 |
石灰石表面有大量的气泡冒出 |
现象同稀盐酸相似 |
总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液本身变色。
(2)酸溶液与某些金属反应
酸溶液 + (氢前)金属 → 盐溶液 + 氢气
注意:A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放热现象;
C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;
D.该类反应属于置换反应
如:Zn + 2HCl == ZnCl2 + H2↑; Fe + H2SO4 == FeSO4 + H2↑
(3)酸溶液与某些金属氧化物反应
酸溶液 + 金属氧化物 → 盐溶液 + 水
注意:该反应过程中,金属元素的化合价不变,酸中的原子团不变
如:CuO + 2HCl == CuCl2 + H2O; Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
ZnO + 2HNO3 == Zn(NO3)2+H2O
(4)酸溶液与某些盐反应
酸溶液 + 盐 → 新酸 + 新盐
注意:A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是:
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳
如:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑;Na2CO3 + H2SO4 == Na2SO4 + H2O + CO2↑;
K2CO3 + 2HNO3 == 2KNO3 + H2O + CO2↑;MgCO3 + CH3COOH == (CH3COO)2Mg + H2O + CO2↑;
B.某些特殊的盐能与酸反应,生成特殊的沉淀
如:HCl + AgNO3 == AgCl↓+ HNO3 ;BaCl2 + H2SO4 == BaSO4↓+ 2HCl
补充: Cl-及SO42-的检验
A.向待测溶液中加入AgNO3溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有Cl-,如果没有沉淀或者沉淀消失,则不含有Cl-。
B.向待测溶液中加入Ba(NO3)2溶液后有白色沉淀生成,滴入稀硝酸溶液后,沉淀不消失,则溶液中含有SO42-,如果没有沉淀或者沉淀消失,则不含有SO42-。
二.常见的碱
1.有关碱的一些性质比较
|
实验内容 |
实验现象 |
|||
|
烧碱、消石灰、氨水物理性质的比较 |
|
烧碱 |
消石灰 |
氨水 |
|
颜色 |
白色 |
白色 |
无色 |
|
|
状态 |
片状固体 |
粉末状固体 |
液体 |
|
|
气味 |
无味 |
无味 |
有氨臭气味 |
|
|
溶解性 |
易溶 |
微溶 |
易溶 |
|
|
俗名 |
烧碱、火碱 |
熟石灰、消石灰 |
|
|
|
烧碱、氨水露置在空气中发生的变化 |
烧碱露置在空气中,表面出现潮湿,这个现象称为潮解。同时氢氧化钠也会吸收空气中的二氧化碳而质变,生成碳酸钠。 氨水露置在空气中,会使其溶质质量分数变小 |
|||
|
烧碱在水中的溶解情况 |
放出大量的热,水溶液具有滑腻感。 |
|||
|
在硫酸铜溶液中滴加石灰水 |
出现蓝色沉淀。CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4↓ |
|||
烧碱具有强腐蚀性,氢氧化钙和氨水也具有一定的腐蚀性。
氢氧化钠溶液能够与头发、鸡蛋清、植物油等发生化学反应,溶解其中的蛋白质。
2.碱的共同性质
由于碱电离后都能生成OH-,因此也具有相同的性质
如:NaOH == Na+ + OH-;NH3•H2O == NH4++OH-;
(1)与酸碱指示剂作用
A.紫色石蕊试剂或红色石蕊试纸遇到碱溶液变蓝;
B.无色酚酞遇到碱溶液变红
(2)与某些非金属氧化物反应
碱溶液 + 非金属氧化物 → 盐 + 水
如:2NaOH + CO2 == Na2CO3 + H2O;Ca(OH)2 + SO2 == CaCO3↓ + H2O;
(3)能与某些盐反应
碱溶液 + 盐溶液 → 新盐 + 新碱
如:CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;CuSO4 + 2NaOH == Na2SO4 + Cu(OH)2↓
Ca(OH)2+Na2CO3==2NaOH+CaCO3↓
3.复分解反应:有两种化合物相互交换成分,生成另外两种化合物的反应。
可以用:AB + CD == AD + CB 表示
特点:(1)反应物、生成物均只有两种化合物;
(2)发生反应的两种化合物相互交换成分;
(3)各元素的化合价在反应前后均不改变。
典型例题:
例1.下列各物质露置在空气中,一段时间后,物质的总质量会增加的是( )
A.浓盐酸 B.浓硝酸 C.浓硫酸 D.石灰水
分析:浓盐酸、浓硝酸具有挥发性,能够挥发出HCl、HNO3气体,从而使其质量减少;浓硫酸具有吸水性,吸收空气中的水分而使其质量增加,石灰水中的Ca(OH)2能吸收空气中CO2生成CaCO3沉淀,使其质量增加。
故答案为:C、D
例2.下列化学方程式正确的是( )
A.2Fe + 6HCl == 2FeCl3 + 3H2↑ B.Fe2O3 + 4HCl == 2FeCl2 + 3H2O
C. Na2CO3 + 2HNO3 == 2NaNO3 + H2O + CO2↑ D.Zn + 2HNO3 == Zn(NO3)2 + H2↑
分析:A错,铁在置换反应中只能生成二价铁,和盐酸反应生成FeCl2而不是FeCl3;B错,Fe2O3与盐酸反应生成物中,化合价应保持不变,因而该生成氯化铁而不是氯化亚铁;D错,硝酸具有强氧化性,与锌反应后,不能生成氢气,只能生成水。故答案为C。
例3 某同学用一根玻璃棒蘸取少量稀硫酸,涂在蓝色石蕊试纸上,一段时间后,请你猜测可能出现的现象,并说明原因。
分析:稀硫酸是酸溶液,显酸性,故能使蓝色石蕊试纸变红,但一段时间后,随着试纸上的水分蒸发,稀硫酸也随之转变为浓硫酸,浓硫酸具有脱水性,能使某些物质脱水,试纸被脱水后炭化,所以,我们一段时候后可能可以看到试纸逐渐变黑。
例4 下列金属与相同质量分数的稀硫酸反应放出氢气最快的是( )
A.Zn B.Fe C.Mg D.Al
分析:金属与酸发生反应生成氢气的速度,与其金属活动性顺序表有关,排在越前面的金属,反应速度越快,剧烈程度越大。根据金属活动性顺序表,Mg排在最前面,因此,放出氢气最快。故答案为C
例5 相同质量的下列金属与足量的等质量的同浓度的稀硫酸反应,产生氢气质量最多的是( )
A.Zn B.Fe C.Mg D.Al
分析:根据化学方程式,金属与酸反应生成氢气的质量有这样的一个规律,等质量的金属与足量的酸反应,若生成盐中的金属元素化合价相同,则金属元素相对原子质量越小,生成氢气质量越大。Fe、Mg、Zn等都是+2价的,但Al等是+3价,Na为+1价,遇到此类情况,有个经验公式:
氢气的质量,故设金属的质量均为mg,则根据该公式代入计算。
Zn、Fe、Mg、Al分别能放出氢气的质量为,故答案为D
例6 下列区别稀硫酸和稀盐酸的方法中,正确的是( )
A.分别加入碳酸钠 B.分别加入硝酸银溶液
C.分别加入氯化钡溶液 D.用pH试纸分别测其溶液的pH
分析:A不正确,稀硫酸与稀盐酸均可以与碳酸钠发生反应,生成二氧化碳气体,现象相同,不能分别。B不正确,硝酸银与盐酸反应:AgNO3 + HCl == AgCl↓+ HNO3,现象为白色沉淀;硝酸银与硫酸混合后,2AgNO3 + H2SO4 == Ag2SO4 + 2HNO3;Ag2SO4微溶于水,看到的现象也可能是白色沉淀,故无法清楚的分辨;C正确,盐酸与氯化钡不能发生反应,而稀硫酸与氯化钡溶液反应;BaCl2 + H2SO4==BaSO4↓+2HCl,白色沉淀,两者现象不同,故能分辨;D错误,pH只与氢离子浓度有关。答案为C。
同步习题:
1.下列物质①FeCl3 ②ZnCl2 ③CuCl2 ④AlCl3中,能用金属和盐酸直接反应制得的物质是( )
A. ①② B. ②④ C. ③④ D. ①③
2.质量相等的下列金属与足量的稀硫酸反应,放出氢气最多的是( )
A. Fe B. Al C. Zn D. Mg
3.下列几种溶液久置于空气中,溶质成分不变,但溶质的质量分数减小且溶液质量增加的是( )
A. 浓硫酸 B. 浓盐酸 C. 浓硝酸 D. 石灰水
4.下列化学反应中,属于复分解反应的是( )
A. Fe + CuSO4 == FeSO4 + Cu B. 2H2O + O2 点燃=== 2H2O
C. CO2 + 2NaOH == Na2CO3 + H2O D. NaOH + HCl == NaCl + H2O
5.下列各组物质的名称或俗称和化学式表示的是同一种物质的是( )
A.熟石灰、消石灰、CaO B.铁锈、氢氧化铁、Fe(OH)3
C.生石灰、消石灰、Ca(OH)2 D.烧碱、火碱、NaOH
6.据报载,一辆满载浓硫酸的槽罐车在路上因车祸翻倒,为了不污染旁边的水源,下列采取的措施适宜的是( )
A.用水冲洗泄漏的浓硫酸 B.将熟石灰撒在泄漏出的浓硫酸上
C.将氯化钡撒在泄漏出的浓硫酸上 D.用土将泄漏的浓硫酸掩埋
7.有些胃病是由于胃酸过多引起的,治疗的药物中常含有氢氧化铝,它的作用可用下面的化学方程式表示:Al(OH)3+3HCl==AlCl3+3H2O,该反应类型属于( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
8.下列物质与盐酸反应时,无明显现象的是( )
A.锌 B.硝酸钾溶液 C.氧化铜 D.氢氧化钾溶液
9.某硫酸溶液分别于下列物质完全反应,所得的溶液酸性基本不变的是( )
A.氯化钡 B.碳酸钠 C.氢氧化钠 D.氧化铜
10.下列物质不能与锌发生置换反应生成氢气的是( )
A.稀硫酸 B.盐酸 C.硝酸 D.浓硫酸
11.50g镁、锌、铁的混合物与足量的稀硫酸反应得到的混合溶液,蒸发后得到218g固体(已经换算成为硫酸盐),则反应生成氢气的质量( )
A.2g B.3g C.3.5g D.4.5g
12.有硝酸银溶液、碳酸钠溶液、氢氧化钠溶液,可一次鉴别它们的试剂是( )
A.稀硝酸 B.氯化钠溶液 C.稀盐酸 D.石蕊试剂
13.用废铜制取硫酸铜,有人用以下两个实验方案:
甲方案:废铜![]() 硫酸铜[Cu+2H2SO4(浓)==CuSO4+2H2O+SO2↑]
硫酸铜[Cu+2H2SO4(浓)==CuSO4+2H2O+SO2↑]
乙方案:废铜![]() 氧化铜
氧化铜![]() 硫酸铜
硫酸铜
你认为比较合理的是___________,原因__________________________________。
14.固体氢氧化钠必须密封保存,是因为它在空气中不仅易_____________,该变化属于物理变化,而且还能跟_________发生,该反应的化学方程式为__________________________;检验该固体是否变质可选用试剂的化学式为_________;除去该杂质的化学方程式为_____________________________________________。
15.用化学方程式回答下列问题:
(1)工厂烧煤的烟囱里冒出的烟气中含有SO2,常污染环境,为什么可以用氢氧化钠溶液来吸收该气体?
___________________________________________________________________
(2)用石灰乳(氢氧化钙的悬浊液)与硫酸铜溶液混合,可以配制防治葡萄等作物病害的波尔多液。请你写出在配制过程中发生的化学反应方程式:____________________________。
(3)用稀硫酸去除铁锈的原理:____________________________________________。
(4)用硝酸来除去水垢(主要成分为碳酸钙)________________________________________。
16.有失去标签的硫酸、盐酸、氢氧化钠三瓶溶液。拟用BaCl2溶液和酚酞试液按下列步骤鉴别:
(1)从三支试管分别移取各溶液少许作试样,向试样中分别滴加___________,如发生的现象是___________,所取得溶液是H2SO4,相关的化学方程式为:_______________________;
(2)将剩余的两种试样各取少许放入另外两支试管中,分别滴加_____________,如发生现象为____________,所取得溶液为NaOH溶液。
(3)无明显现象的为______________________。
17.蛋腐败时会产生一种无色、有臭鸡蛋气味的硫化氢气体(H2S),H2S气体是一种大气污染物,它在空气完全燃烧时,生成了二氧化硫和水。把H2S气体通入浓H2SO4中,发生的反应为:
H2S + H2SO4(浓)==SO2 + X↓+ 2H2O
(1)上述内容中,属于H2S的物理性质是_______________________________________;
(2)写出H2S在空气中完全燃烧的化学方程式:_________________________;
(3)H2S气体通入浓H2SO4中反应时,生成物中X的化学式为________________;
(4)若尾气中含有H2S,用浓硫酸来吸收行吗?为什么?_____________________________;若你来建议,你认为使用何种试剂能达到吸收的效果?请写出相应的化学方程式________________________。
18.部分被氧化的铁片10g与200g的稀硫酸恰好完全反应,产生0.3g,求该该硫酸溶液的溶质质量分数?
参考答案:
1.B 2.B 3.A 4.D 5.D 6.A 7.D 8.D 9.A 10.C、D 11.C
12.C 13.乙同学;(1)不产生污染性气体,(2)产生相同质量的硫酸铜,乙方案硫酸用量少;
14.潮解 空气中的二氧化碳 2NaOH + CO2 == Na2CO3 + H2O;盐酸Na2CO3+2HCl==2NaCl+H2O+CO2↑
15.(1)2NaOH + SO2 == Na2SO3 + H2O;(2)CuSO4 + Ca(OH)2 == Cu(OH)2↓+ CaSO4;
(3)Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O;(4)CaCO3 + 2HNO3 == Ca(NO3)2 + H2O + CO2↑;
16.BaCl2溶液 白色沉淀 BaCl2 + H2SO4 == BaSO4↓+ 2HCl 酚酞试剂 试剂变为红色 盐酸
17.(1)无色、有臭鸡蛋气味的气体;(2)2H2S + 3O2 === 2SO2 + 2H2O;(3)S
(4)不行,产生的SO2气体仍然是污染性气体 用氢氧化钠溶液 H2S + 2NaOH == Na2S + 2H2O
18.22.0%
相关推荐
以上就是本文的全部内容,更多精彩内容,请持续关注长春新东方网。

新东方长春学校官方微信:新东方长春学校 (微信号:ccxdfcn)
最新考试资讯、考试政策解读、真题解析,请扫一扫二维码,关注我们的官方微信!
相关推荐
版权及免责声明
①凡本网注明"稿件来源:新东方"的所有文字、图片和音视频稿件,版权均属新东方教育科技集团(含本网和新东方网) 所有,任何媒体、网站或个人未经本网协议授权不得转载、链接、转贴或以其他任何方式复制、发表。已经本网协议授权的媒体、网站,在下载使用时必须注明"稿件来源:新东方",违者本网将依法追究法律责任。
② 本网未注明"稿件来源:新东方"的文/图等稿件均为转载稿,本网转载仅基于传递更多信息之目的,并不意味着赞同转载稿的观点或证实其内容的真实性。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。如擅自篡改为"稿件来源:新东方",本网将依法追究法律责任。
③ 如本网转载稿涉及版权等问题,请作者见稿后在两周内速来电与新东方网联系,电话:010-60908555。